Cuando nos preguntamos por qué es importante estudiar la matriz extracelular.
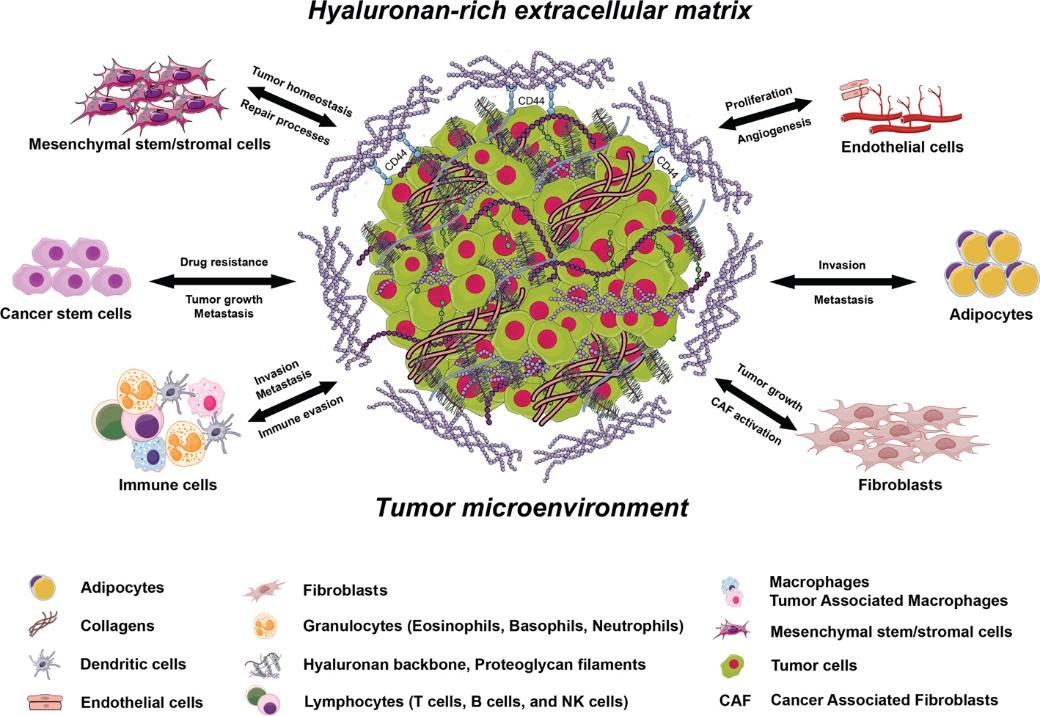
El microambiente de todos los tejidos animales está constituido en gran proporción por una matriz extracelular (MEC) que no solo otorga soporte físico a las células que lo componen, sino que ejerce sobre ellas múltiples funciones, induciendo efectos biomecánicos y señales intercelulares. Estas funciones abarcan desde mantener el estado stem de ciertos tipos celulares hasta dirigir su diferenciación y por lo tanto, determinar el rol que cumplirá cada célula en el tejido o el microambiente del cual es parte. Por esta razón, los estudios de la Biología y Bioquímica Celular hacen que sea imprescindible conocer acerca de esta estructura compleja tridimensional y cómo influye en cada uno de los procesos celulares conocidos. Muchas veces, esto permite explicar fenómenos que parecen contradecir a los esperados cuando se estudia a la célula aislada de su entorno sin asociarla a una MEC.
Por definición la MEC es una compleja estructura tridimensional formada por diferentes macromoléculas: proteínas y glicoproteínas, glucosaminoglicanos (GAGs: como el ácido hialurónico) y proteoglicanos (PGs: formados por GAGs como heparán, condroitin, keratan o dermatan sulfato unidos a un core proteico). Estos componentes de la MEC se distribuyen y conectan entre sí de acuerdo a la función del tejido donde se encuentran. Generalmente, en la mayoría de los tejidos animales pueden distinguirse distintos tipos de MEC: a) una membrana basal más bien rígida, básicamente compuesta de colágeno tipo IV, laminina, fibronectina y proteínas linkers sobre la cual se organizan las células epiteliales y b) una matriz intersticial, considerada el espacio existente entre las distintas células y constituida principalmente por PGs y GAGs, colágeno fibrilar, glicoproteínas y electrolitos que le dan mayor elasticidad e hidratación al tejido circundante [1]. Sin embargo, la composición de esta MEC es variable entre los diferentes tejidos. A modo de ejemplo, la MEC del tejido óseo presenta claras diferencias con la matriz que contiene a las células sanguíneas, el plasma. Actualmente, las herramientas –ómicas y los análisis in silico e in vivo han permitido definir un amplio conjunto de componentes principales y asociados de la MEC integrados en lo que llamamos “matrisoma”, cuyo análisis permite estudiar de forma integral un estado fisiopatológico determinado [2] (visitar: http://matrisomedb.pepchem.org/)
Lo notable de la MEC es que su composición y topografía está finamente regulada para mantener la homeóstasis tisular; sin embargo, la excesiva degradación o la síntesis desregulada de alguno de sus componentes induce o perpetua un estado patológico. Tal como se mencionó previamente, con sus propiedades bioquímicas, físicas y mecánicas, la MEC es capaz de regular el comportamiento celular. Las propiedades físicas como la rigidez, porosidad, solubilidad, orientación y rearreglo espacial de sus componentes definen su función como soporte de los tejidos, barrera y sitio de anclaje. Esto afecta el movimiento de las células, impidiendo o facilitando la migración, la diferenciación y la división celular. Bioquímicamente, la MEC es un reservorio de factores de crecimiento y diferenciación que inducen señales celulares a través de receptores de superficie celulares, o inclusive algunos componentes, como los PGs, pueden actuar como co-receptores. Los propios componentes de la MEC o fragmentos de esta que se generan por acción de enzimática (por ejemplo, metaloproteinasas o MMPs) o química (eje, radicales libres), también pueden tener sus receptores a nivel celular, en general definidos como parte de las moléculas de adhesión. Más aun, la MEC limita o favorece la accesibilidad de estos factores para que interactúen con la célula e induzcan la señal. Por último, las propiedades biomecánicas determinan la elasticidad de la MEC, pudiendo ser plenamente elástica (soft), hasta espesa o rígida (stiff). Estas propiedades también son censadas por la célula por su citoesqueleto generando señales que se trascriben al núcleo y regulan la expresión génica. Estas propiedades de la MEC están interrelacionadas, y la interacción con la célula es bidireccional, por lo cual estas últimas también son capaces de modificar su MEC, ya sea a través del nivel de expresión o síntesis de sus componentes, o mediante la acción de distintas enzimas que los degradan o inducen entrecruzamientos entre ellos [3].
Durante décadas resultó dificultoso el aislamiento de los componentes insolubles de la MEC para su estudio. No obstante, las nuevas tecnologías de investigación como las herramientas para el análisis genómico, transcriptómico y proteómico han facilitado su análisis, y han determinado el matrisoma, como se mencionó anteriormente. Por otro lado, las técnicas de espectrometría de masa adaptadas al estudio de la MEC han permitido su caracterización experimental en tejidos sanos o patológicos, y herramientas como la glicómica o glicoproteómica han definido cambios de ese matrisoma, que a su vez determinan lo que se llama “matreotipo”: los cambios post-transcripcionales de componentes de la MEC en un determinado estado de salud, causado por una enfermedad, envejecimiento, fenotipo, etc [4]. Por último, el advenimiento del uso de cultivos celulares 3D en sistemas microfluídicos o de microcanales permitirá en la actualidad el estudio de la MEC in vitro en forma controlada y emulando los sistemas de estudio in vivo, reduciendo además el uso de modelos animales.
Es claro que el estudio de la MEC ha permitido una mayor compresión de los mecanismos celulares que mantienen tanto la homeostasis como aquellos que ocurren en enfermedades como la fibrosis hepática, cardiovasculares, cáncer [5], alteraciones de la respuesta inmune [6], entre otras. Sin embargo, en la actualidad su estudio atrae un gran interés a la hora de determinar nuevos blancos moleculares terapéuticos y/o de diagnóstico, biomarcadores, como así también diseñar estrategias de regeneración tisular o prevención del envejecimiento y de resistencia a drogas.
Dra. Laura Alaniz, Investigadora Independiente CONICET. Prof. Asociada UNNOBA
Directora del Laboratorio de Microambiente Tumoral, CIBA (UNNOBA), CIT NOBA (CONICET-UNSAdA-UNNOBA).
Jorge Newbery 261, Junín (B6000), Bs. As. Argentina. Email: ldalaniz@comunidad.unnoba.edu.ar